- Новости науки и техники
- Биология и медицина
N + 1 — главное издание о науке, технике и технологиях
Читать ещё
12 декабря 2025, 18:00
Экспериментальный препарат от ожирения от Eli Lilly вызвал рекордную потерю веса у пациентов
Ретатрутид, разрабатываемый компанией Eli Lilly, помог пациентам потерять в среднем 28,7% веса за 68 недель. В отличие от других средств, препарат не приводит к потере мышечной массы и одновременно снижает боль при артрите коленного сустава. Этот эффект достигается за счет имитации трех гормонов (GLP-1, GIP и глюкагона), регулирующих аппетит и метаболизм. Eli L
Читать ещё
Ученые определили четкий биологический механизм, связывающий дисбаланс микробиоты со снижением памяти. Нарушения возникают из-за системного воспаления, вызванного преимущественно приемом препаратов и плохим питанием.
Читать ещё
12 декабря 2025, 10:31
Ученые создали программный пакет для анализа сложных сетей мозга и социальных взаимодействий
Ученые разработали первый общедоступный программный пакет для языка программирования Python, который анализирует сложные сети. Новый инструмент позволяет изучать групповые взаимодействия между тремя и более объектами — от нейронов мозга до социальных связей
Читать ещё
12 декабря 2025, 10:31
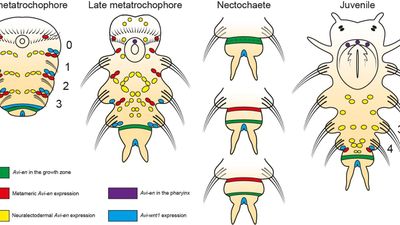
Ученые обнаружили уникальный механизм сегментации у кольчатых червей
Ученые впервые детально описали молекулярный механизм, благодаря которому тело кольчатых червей разделяется на сегменты. Для этого авторы проследили за работой ключевых генов, отвечающих за сегментацию, на всех этапах развития червя-нереиса — от эмбриона до взрослой особи
Читать ещё
11 декабря 2025, 18:40
Ученые нашли скрытые связи между всеми основными психическими расстройствами
Масштабное генетическое исследование более чем миллиона человек показало общие истоки распространенных психических расстройств. Все диагнозы распределили по пяти группам, в которых, например, депрессия оказалась в одной категории с ПТСР, а аутизм с СДВГ. Полученные данные предлагают возможности для более эффективной профилактики психических расстройств, а также указывают на новые стратегии лечения смежных состояний.
Читать ещё
11 декабря 2025, 15:37
Тревожность и бессонница снизили число циркулирующих натуральных киллеров
N + 1 — главное издание о науке, технике и технологиях
Читать ещё
N + 1 — главное издание о науке, технике и технологиях
Читать ещё
11 декабря 2025, 09:28
CRISPR-терапия серповидноклеточной анемии и бета-талассемии помогла детям до 12 лет
N + 1 — главное издание о науке, технике и технологиях
Читать ещё
11 декабря 2025, 06:31
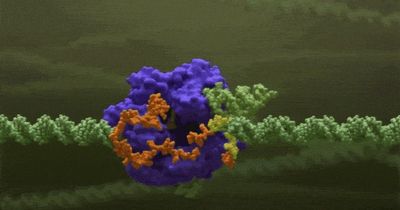
Аптамеры: назад в будущее. Старая концепция в новой технологической реальности
В 1990-х казалось, что аптамеры вот-вот вытеснят антитела.
Читать ещё