- Новости науки и техники
- Биология и медицина
21 февраля 2026, 00:05
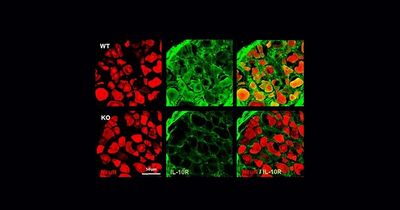
Моноциты помогли мужчинам быстрее женщин избавиться от боли при травме
N + 1 — главное издание о науке, технике и технологиях
Читать ещё
20 февраля 2026, 13:27
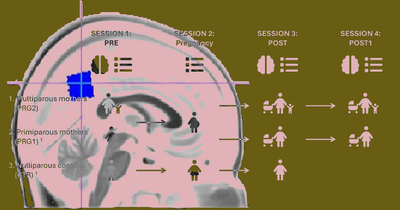
Вторая беременность повлияла на активность сети пассивной работы мозга
N + 1 — главное издание о науке, технике и технологиях
Читать ещё
20 февраля 2026, 12:30
Универсальная назальная вакцина защищает от вирусов, бактерий и аллергенов
Экспериментальная вакцина, созданная учеными Стэнфордского университета, успешно прошла этап доклинических экспериментов. Препарат обеспечил длительную защиту от многих патогенов, включая коронавирусы и бактерии с высоким риском резистентности. Этого удалось добиться благодаря трехкомпонентному составу и нацеливанию на врожденный иммунный ответ.
Читать ещё
20 февраля 2026, 06:04
Молекулярная динамика биомолекул. Часть II. Пионерские работы отечественных ученых
Метод молекулярной динамики (МД) прочно вошел в арсенал физиков, химиков и, конечно, биологов.
Читать ещё
20 февраля 2026, 04:34
Без антибиотиков: небольшое количество пищевой добавки из сибирской лиственницы ускорило рост цыплят-бройлеров
Ученые выяснили, что кверцетин — кормовая добавка растительного происхождения — в зависимости от количества по-разному влияет на микрофлору в кишечнике...
Читать ещё
19 февраля 2026, 19:35
От яда до блокбастера: полная история создания первого инкретинового препарата
Мировой фармацевтический рынок захватили инкретиновые препараты, снижающие уровень сахара в крови.
Читать ещё
19 февраля 2026, 17:28
Япония первой в мире разрешает терапию плюрипотентными стволовыми клетками
Экспертный совет Министерства здравоохранения Японии одобрил два препарата регенеративной медицины на основе индуцированных плюрипотентных стволовых клеток (ИПСК) — лекарство от болезни Паркинсона и от сердечной недостаточности. Если министр здравоохранения утвердит решение экспертов, Япония станет первой страной в мире, разрешившей коммерческую продажу таких продуктов — почти через 20 лет после открытия самой технологии.
Читать ещё
Новая генная терапия может стать для части пациентов с муковисцидозом единственным шансом на улучшение, поскольку позволяет восстановить биологические функции независимо от особенностей генетики.
Читать ещё
19 февраля 2026, 14:07
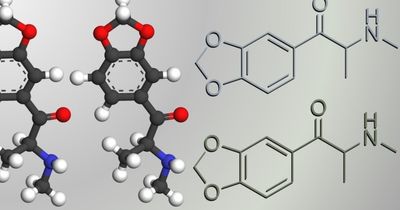
Аналог МДМА облегчил течение посттравматического стрессового расстройства
N + 1 — главное издание о науке, технике и технологиях
Читать ещё
В этой статье речь пойдет о паразите в не совсем привычном понимании этого слова, поскольку им является не живой организм, а ген.
Читать ещё