- Новости науки и техники
- Биология и медицина
02 июля 2025, 17:22
ИИ по снимкам МРТ выявляет ускоренное старение мозга и риски деменции
Ученые разработали ИИ, который использует снимки магнитно-резонансной томографии и выявляет людей с признаками ускоренного старения мозга. Его планируют применять во время скрининга у пожилых и лиц из группы высокого риска нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона.
Читать ещё
02 июля 2025, 15:33
ДНК-датчик позволит проводить анализ на ВИЧ и рак на дому менее чем за $1
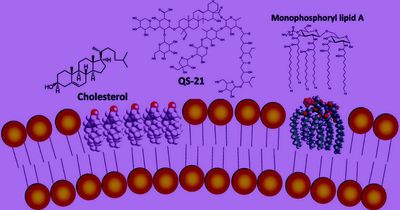
Исследователи Массачусетского технологического института (MIT) разработали недорогие одноразовые диагностические устройства на основе электрохимических датчиков с покрытием из ДНК, которые могут выявлять различные заболевания, включая рак, грипп и ВИЧ. Эти датчики используют фермент из системы редактирования генов CRISPR, который при об
Читать ещё
01 июля 2025, 20:55
Оказалось, что старение связано с воспалением только в индустриальном обществе
Открытие перечеркивает представление ученых о том, что воспаление всегда усиливается с возрастом. Уникальное исследование показало эту тенденцию только у людей, проживающих в городах или индустриально развитых местах. Теперь перед исследователями стоит задача выяснить, что именно приводит к проблемам со здоровьем.
Читать ещё
01 июля 2025, 17:09
В Британии стартовал проект по созданию искусственного генома человека
Британские ученые запустили проект SynHG — первую попытку создать синтетическую ДНК человека с нуля. Исследование финансируется крупнейшей в мире медицинской благотворительной организацией Wellcome Trust, которая уже выделила на эту работу 10 миллионов фунтов стерлингов. Проект обещает революционные открытия в медицине: он может привести к созданию новых методов лечения и помочь
Читать ещё
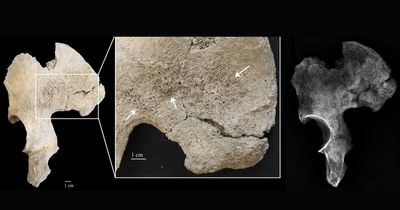
Ученые из Швеции сделали удивительное открытие, которое меняет представление о природе нейродегенерации. Впервые исследователи обнаружили у новорожденных детей биомаркеры болезни Альцгеймера — повышенный уровень белка тау p-tau217, однако это никак не вредило развитию мозга. Причем у недоношенных он был особенно высок, затем примерно к году приходил в норму. Это значит, что тау-белок каким-то образом защищает мозг, но механизм работы этой защиты ученым пока не понятен. Открытие ставит под сомнен
Читать ещё
01 июля 2025, 15:43
Грибок-убийца из гробницы Тутанхамона оказался ключом к лечению лейкемии
Исследователи из Университета Пенсильвании сумели очистить и модифицировать некоторые асперигимицины, чтобы те могли проникать в раковые клетки
Читать ещё
N + 1 — главное издание о науке, технике и технологиях
Читать ещё
Ранний органогенез является важнейшей стадией эмбрионального развития, и доскональное понимание этого процесса может дать ответ на вопрос, как формируется жизнь на уровне одной клетки. Разработка трехмерной цифровой модели зародыша мыши, которую воплотила команда специалистов из Китая, позволит ученым глубже понять то, как развивается врожденный порок сердца и другие заболевания, а также даст представление о регенерации органов и лечении рака.
Читать ещё
30 июня 2025, 16:35
Найден механизм, запускающий регенерацию любой ткани у млекопитающих
Китайские ученые обнаружили механизм, запускающий регенерацию любой ткани у млекопитающих. Эволюционно от отключен. Его «включение» у травмированных мышей привело к регенерации ушной раковины и связывающих нервов. Авторы утверждают, что новый подход универсален и может произвести революцию в лечении повреждений органов и травм — от хирургии до кардиологии.
Читать ещё
N + 1 — главное издание о науке, технике и технологиях
Читать ещё